KELARUTAN DAN HASIL KALI KELARUTAN
A. PENGERTIAN KELARUTAN
Kemampuan garam-garam larut dalam air tidaklah sama, ada garam yang mudah larut dalam air seperti natrium klorida dan ada pula garam yang sukar larut dalam air seperti perak kloida (AgCl). Apabila natrium klorida dilarutkan ke dalam air, mula-mula akan larut. Semakin banyak natrium klorida ditambahkan ke dalam air, semakin banyak endapan yang diperoleh. Larutan yang demikian itu disebut larutan jenuh artinya pelarut tidak dapat lagi melarutkan natrium klorida. Perak klorida sukar larut dalam air, tetapi dari hasil percobaan ternyata jika perak klorida dilarutkan dalam air diperoleh kelarutan sebanyak mol dalam setiap liter larutan.
Berdasarkan contoh diatas dapat diketahui bahwa selalu ada sejumlah garam yang dapat larut didalam air. Bagi garam yang sukar larut dalam air, larutan akan jenuh walau hanya sedikit zat terlarut dimasukkan, sebaliknya bagi garam yang mudah larut dalam air, larutan akan jenuh setelah banyak zat terlarut dilarutkan. Ada sejumlah maksimum garam sebagai zat terlarut yang selalu dapat dilarutkan kedalam air. Jumlah maksimum zat terlarut dalam pelarut disebut kelarutan.
B. PENGERTIAN HASIL KALI LARUTAN
Hasil kali kelarutan ialah hasil kali konsentrasi ion-ion dari larutan jenuh garam yang sukar larut dalam air, setelah masing-masing konsentrasi dipangkatkan dengan koefisien menurut persamaan ionisasinya.
Garam-garam yang sukar larut seperti , AgCl , HgF2. Jika dimasukkan dalam air murni lalu diaduk, akan terlarut juga walaupun hanya sedikit sekali. Karena garam-garam ini adalah elektrolit, maka garam yang terlarut akan terionisasi, sehingga dalam larutan akan terbentuk suatu kesetimbangan.
C. Faktor-Faktor yang Mempengaruhi Kelarutan
1. Jenis Pelarut
Pernahkan kalian mencampurkan minyak dengan air? Jika pernah, pasti kalian telah mengetahui bahwa minyak dan air tidak dapat bercampur. Sebab, minyak merupakan senyawa non-polar, sedangkan air merupakan senyawa polar. Senyawa non-polar tidak dapat larut dalam senyawa polar, begitu juga sebaliknya. Jadi, bisa disimpulkan bahwa kedua zat bisa bercampur, asalkan keduanya memiliki jenis yang sama.
2. Suhu
Kalian sudah mengetahui bahwa gula lebih cepat larut dalam air panas daripada dalam air dingin, bukan? Kelarutan suatu zat berwujud padat semakin tinggi, jika suhunya dinaikkan. Dengan naiknya suhu larutan, jarak antarmolekul zat padat menjadi renggang. Hal ini menyebabkan ikatan antarzat padat mudah terlepas oleh gaya tarik molekul-molekul air, sehingga zat tersebut mudah larut.
3. Pengadukan
Dari pengalaman sehari-hari, kita tahu bahwa gula lebih cepat larut dalam air jika diaduk. Dengan diaduk, tumbukan antarpartikel gula dengan pelarut akan semakin cepat, sehingga gula mudah larut dalam air.
2. Kesetimbangan Kelarutan
3. Hasil Kali Kelarutan (Ksp)
· Adalah nilai tetapan kesetimbangan garam atau basa yang sukar larut dalam larutan jenuh
· Dapat dikaitkan dengan kelarutan sesuai dengan stokiometri reaksi
Pada larutan jenuh terjadi kesetimbangan antara ion-ion dengan zat yang tidak larut. Proses ini terjadi dengan laju reaksi yang sama sehingga terjadi reaksi kesetimbangan. Contohnya reaksi kesetimbangan pada larutan jenuh CaC2O4 dalam air adalah:
CaC2O4(s) ↔ Ca2+ (aq) + C2O4(aq)
Konstanta kesetimbangan:
Oleh karena CaC2O4 yang larut dalam air sangat kecil maka konsentrasi CaC2O4dianggap tetap. Sesuai dengan harga K untuk kesetimbangan heterogen, konstanta reaksi ini dapat ditulis:
Ksp = [Ca2+] [C2O42-]
Ksp atau konstanta hasil kali kelarutan adalah hasil kali konsentrasi ion-ion dalam larutan jenuh, dipangkatkan masing-masing koefisien reaksinya.
Rumus dan harga Ksp beberapa senyawa dapat dilihat pada Tabel
4. Pengaruh Ion Senama
· Ion senama memperkecil kelarutan
· Ion senama dari elektrolit yang sukar larut dapat diabaikan
Dalam larutan jenuh Ag2CrO4 terdapat kesetimbangan antara Ag2CrO4 padat dengan ion Ag+ dan ion CrO42–.
Dalam larutan jenuh Ag2CrO4 terdapat kesetimbangan antara Ag2CrO4 padat dengan ion Ag+ dan ion CrO42–.
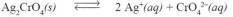
Apa yang terjadi jika ke dalam larutan jenuh tersebut ditambahkan larutan AgNO3 atau larutan K2CrO4? Penambahan larutan AgNO3 atau K2CrO4 akan memperbesar konsentrasi ion Ag+ atau ion CrO42– dalam larutan.

Sesuai asas Le Chatelier tentang pergeseran kesetimbangan, penambahan konsentrasi ion Ag+ atau ion CrO42– akan menggeser kesetimbangan ke kiri. Akibatnya jumlah Ag2CrO4 yang larut menjadi berkurang. Jadi dapat disimpulkan bahwa ion senama memperkecil kelarutan (Keenan, 1992).
5. Reaksi Pengendapan
· Qc < Ksp : larutan belum jenuh
· Qc = Ksp : larutan tepat jenuh
· Qc > Ksp : terjadi pengendapan
6. Hubungan Ksp dengan pH
Harga pH sering digunakan untuk menghitung Ksp suatu basa yang sukar larut. Sebaliknya, harga Ksp suatu basa dapat digunakan untuk menentukan pH larutan (James E. Brady, 1990).
CONTOH SOAL:
1. Diketahui Ksp AgCl = 1,8 x 10 -10 .
Tentukan :
a. kelarutan AgCl dalam air!
b. kelarutan AgCl dalam HCl 0,01 M!
2.100 ml larutan MgCl 2 0,01 M dicampurkan dengan 100 ml K 2 CO 3 0,001 M. Jika Ksp MgCO 3 = 3,5 x 10 -5, apakah MgCO 3 yang terbentuk sudah mengendap?
3. Diketahui Ksp Ag2CrO4 pada suhu 25C adalah 2,4 x 10–12. Tentukan kelarutan Ag2CrO4 dalam air pada suhu 25C dan konsentrasi Ag+ dalam keadaan jenuh.
Jawab:
Ag2(CO3)2 —> 2Ag+ + CO3-
s 2s s
Ksp Ag2CO3 = [Ag+]2 [CO3-]
Jawab:
Ag2(CO3)2 —> 2Ag+ + CO3-
s 2s s
Ksp Ag2CO3 = [Ag+]2 [CO3-]
2,4 x 10–12 = (2s)2 (s)
2,4 x 10–12 = 4s3
s3 = 0,6 x 10–12
s = 8,4 x 10–5
Konsentrasi [Ag+] = 2s = 2 (8,4 x 10–5) = 1,68 x 10–4 mol/L
4. Ke dalam 5000 ml air dilarutkan glukosa sampai jenuh. Ternyata massa glukosa yang terlarut adalah 9 gram glukosa (Mr=180), tentukan kelarutan glukosa tersebut!
Jawab:
Jawab:
n = gr/Mr
n = 9/180
n = 0.05 mol
V = 5000 ml
= 5 L
s = n/v
s = 0.05/5
s = 0.01 mol/liter
65. Apakah terjadi pengendapan CaCO3. jika ke dalam 1 liter 0.05 M Na2CO3 ditambahkan 1 liter 0.02 M CaCl2, dan diketahui harga Ksp untuk CaCO3 adalah 10-6.
Jawab :
maka :
[Ca2+] x [CO32-] = 2.5 x 10-2 x 10-2
= 2.5 x 10-4
karena :
[Ca2+] x [CO32-] > Ksp CaCO3, maka akan terjadi endapan CaCO3



