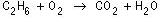Tata Nama Senyawa
Metode sistematik untuk penamaan senyawa disebut Sistem Tata Nama. Sistem ini disusun berdasarkan aturan dari IUPAC (International Union of pure and Apllied Chemistry). Senyawa dapat dibedakan menjadi 4, yaitu : Senyawa Biner, senyawa poliatomik, senyawa asam, dan senyawa basa.
A.SENYAWA BINER
Senyawa Biner adalah senyawa yang dibentuk dari dua unsur. Senyawa biner dapat terbentuk dari satu unsur logam dan satu unsur nonlogam atau kedua-duanya unsur nonlogam. Jika unsur pertama adalah logam dan unsur lainnya adalah nonlogam, maka senyawa biner tersebut umumnya berbentuk ionik atau senyawa biner
Cara penamaan senyawa biner untuk :
a. LOGAM DAN NON LOGAM
- Menuliskan nama usnur logam tanpa modifikasi apapun, kemudian diikuti nama unsur nonlogam dengan akhiran “-ida”. Contoh : NaCl = Natrium klorida
- Unsur logam dengan bilangan oksidasi lebih dari satu jenis, maka bilangan oksidasinya ditulis dengan angka romawi serta diletakkan diantara nama logam dan nonlogam. Misalnya : FeF3 = Besi (III) florida
b. NONLOGAM DAN NON LOGAM
Penamaan secara umum sama dengan penamaan pada senyawa logam dan nonlogam, hanya saja rumus dan senyawanya dituliskan dengan memandang mana yang memiliki bilangan oksidasi positif baru kemudian diikuti unsur dengan bilanga oksidasi negatif. Misalkan HCl à Hidrogen klorida dab bukan ClH
Unsur yang membentuklebih dari senyawa biner memakai awalan bahasa lain 1=mono, 2=di, 3=tri, 4=tetra, 5=penta, 6=heksa, 7=penta, 8=okta, 9=nona, 10=deka.
Contoh : CO2 = Karbon dioksida, N2O5 = Dinitrogen pentaoksida
SENYAWA POLIATOMIK
Senyawa poliatomik merupakan senyawa yang dibentuk dari ion poliatomik. Pada ion poliatomik, dua atau lebih atom-atom bergabung bersama-sama dengan ikatan kovalen.
Senyawa yang tersusun lebih dari dua unsur digolongkan sebagai senyawa poliatom, seperti Ca(ClO)2 atau kaporit, NaCO3 (soda kue), dan H2SO4 (asam sulfat). Senyawa poliatom umumnya mengandung oksigen. Tata nama senyawa poliatom yang mengandung oksigen didasarkan pada jumlah atom oksigen yang dikandungnya. Senyawa yang mengandung jumlah oksigen paling banyak diberi akhiran -at, sedangkan yang paling sedikit diberi akhiran -it.
Contoh:
Na2SO4 (natrium sulfat), Na2SO3 (natrium sulfit)
KClO3 (kalium klorat), KClO2 (kalium klorit).
Tata nama senyawa tersebut tidak memadai setelah ditemukan senyawa yang mengandung atom oksigen lebih banyak atau lebih sedikit dari senyawa tersebut. Untuk itu, senyawa yang mengandung atom oksigen lebih banyak lagi diberi awalan per-, sedangkan senyawa yang lebih sedikit dari contoh senyawa di atas diberi awalan hipo-.
Contoh:
KClO4 dinamakan kalium perklorat
KClO3 dinamakan kalium klorat
KClO2 dinamakan kalium klorit
KClO dinamakan kalium hipoklorit
Catatan tentang senyawa poliatomik :
a. Anion umumnya lebih banyak jumlahnya dibanding kation.
b. Kation yang paling populer adalah NH4+.
c. Anion kebanyakan memakai akhiran “-it” dan “-at” serta awalan”hipo-“ atau “hiper-“
d. Oksigen dapat membentuk banyak senyawa anionpoliatom yang disebut anion okso
e. Penamaan berdasarkan tingkat oksidasi dari atom-atom yang mengikat oksigen dari yang terkecil “hipo-“ dan yang tertinggi “per-“
f. Semua anioan okso dari Cl, Br, dan I memiliki muatan -1
g. Awalan “tio-“berarti bahwa satu atom sulfur telah ditambahkan untuk menggantikan satu atom oksigen (ion sulfat memiliki satu atom S dan 4 atom . ion tiosulfat memiliki 2 atom S dan 3 atom O)
SENYAWA ASAM DAN BASA
Pembawa sifat asam adalah ion H+ dan pembawa sifat Basa adalah ion OH-. Senyawa sam biner merupakan senyawa gabungan H dengan atom-atom nonlogam, misalnya : HCl = Asam klorida, HBr = Asam bromida (nama asam disebutkan lebih dahulu). Pada senyawa basa penamaan senyawa basa dituliskan dengan menyebutkan nama atom yang terkat pada ion OH- dan diikuti dengan akhiran hidroksida.
Contoh : NaOH = Natrium hidroksida, Al(OH)3 = Aluminium hidroksida.
B. Rumus Kimia
Rumus kimia didefinisikan sebagai rumus suatu zat yang menggunakan lambang dan jumlah atom-atom unsur penyusun senyawa. Dalam rumus kimia, bilangan yang menyatakan jumlah unsur ditulis dalam bentuk indeks bawah (tikalas) setelah lambang unsurnya.
1. Rumus Empirik dan Rumus Molekul
Untuk menentukan rumus molekul suatu senyawa dilakukan dalam dua tahap. Tahap pertama, menentukan unsur-unsur yang terkandung dalam senyawa dan komposisinya. Temuan yang diperoleh dinamakan rumus empirik. Tahap kedua, menentukan massa molekul relatifnya.
Rumus empirik adalah rumus paling sederhana dari suatu molekul, yang hanya menunjukkan jenis dan perbandingan terkecil dari unsur yang menyusun senyawa itu. Contoh: 1. Rumus empirik etena adalah CH2. Rumus sesungguhnya dari etena adalah C2H4. 2. Rumus empirik amonia adalah NH3. Rumus sesungguhnya dari amonia juga NH3. Untuk senyawa berupa molekul(molekuler), penting diketahui berapa jumlah atom sesungguhnya yang terdapat dalam setiap molekul. Hal ini dapat diketahui setelah massa molekul relatif dari molekul ditentukan.
2. Massa Molekul Relatif
Massa molekul relatif ditentukan di laboratorium dengan berbagai metode atau dapat juga dihitung dari massa atom relatif jika jumlah dan jenis unsurnya diketahui. Massa molekul relatif disingkat dengan Mr.
Tinjau molekul amonia dengan rumus molekul NH3. Dalam molekul ini terkandung satu atom nitrogen dan tiga atom hidrogen. Jika Ar N = 14 sma dan Ar H = 1 sma maka rumus molekul relatif NH3 = 17 sma atau Mr NH3 = 17 sma.
3. Rumus Senyawa Ion
Senyawa ion dibentuk melalui serah-terima elektron menghasilkan kation dan anion. Dalam senyawa ion, jumlah muatan kation harus sama dengan muatan anion agar dihasilkan senyawa netral secara listrik.
Tinjau senyawa NaCl. Ion Na+ memiliki muatan positif satu dan ion Cl– memiliki muatan negatif satu sehingga rumus kimianya NaCl.
Tinjau senyawa Na2SO4. Dalam senyawa ini, ion Na+ bermuatan satu, sedangkan ion SO4 2– muatannya dua. Agar senyawa yang dibentuk netral maka diperlukan dua ion natrium untuk ion sulfat. Jadi, rumus kimia
dari natrium sulfat adalah Na2SO4.
Dalam Al2(SO4)3, ion aluminium bermuatan 3+ (Al3+) dan ion sulfat bermuatan 2– (SO4 2–). Agar senyawa yang terbentuk netral maka ion aluminium dikalikan muatan ion sulfat dan sebaliknya sehingga rumus kimianya adalah Al2(SO4)3.
Untuk menentukan rumus kimia dari ionion perlu diperhatikan hal-hal berikut.
a. Tuliskan nama senyawa ionnya.
b. Tuliskan ion-ion yang terlibat.
c. Setarakan muatan positif dan negatif.
d. Tuliskan rumus kimia tanpa muatan.
Senyawa ion berbeda dengan senyawa molekuler. Umumnya senyawa molekuler berupa molekul sebagaimana tersirat dalam rumus kimianya. Adapun senyawa ion membentuk struktur kristal yang sangat besar, tersusun dari kation dan anion secara bergantian. Bagaimana menentukan massa molekul relatif dari senyawa ion? Menentukan massa molekul relatif senyawa ion diambil dari rumus empiriknya.
Contoh:
Walaupun kristal NaCl tersusun dari jutaan ion Na+ dan Cl–, massa molekul relatifnya ditentukan dari satuan rumusnya, yaitu NaCl. Jadi, massa rumus relatif NaCl = Ar Na + Ar Cl = 58,5 sma.
C. Persamaan Reaksi
Persamaan reaksi didefinisikan sebagai persamaan yang menyatakan kesetaraan jumlah zat-zat yang terlibat dalam reaksi kimia dengan menggunakan rumus kimia. Dalam reaksi kimia terdapat zat-zat pereaksi dan zat-zat hasil reaksi. Dalam menuliskan persamaan reaksi, rumus kimia pereaksi dituliskan di ruas kiri dan rumus kimia hasil reaksi dituliskan di ruas kanan. Antara kedua ruas itu dihubungkan dengan anak panah (⎯⎯→ )
yang menyatakan arah reaksi kimia.
Contoh:
Logam magnesium bereaksi dengan gas klorin membentuk magnesium klorida. Tuliskan persamaan reaksinya. Persamaan reaksinya adalah Mg + Cl2 ⎯⎯→MgCl2
1. Menyetarakan Reaksi
Menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai dengan koefisiennya masing-masing.
a. Menuliskan Persamaan Reaksi.
- Reaksi kimia mengubah zat-zat asal (pereaksi = reaktan ) menjadi zat baru (produk).
- – Jenis dan jumlah atom yang terlibat dalam reaksi tidak berubah, tetapi ikatan kimia di antaranya berubah.
- – Ikatan kimia dalam pereaksi diputuskan dan terbentuk ikatan baru dalam produknya.
- – Atom-atom ditata ulang membentuk produk reaksi.
Contoh :
Keterangan :
- Tanda panah menunjukkan arah reaksi (artinya = membentuk atau bereaksi menjadi).
- Huruf kecil dalam tanda kurung menunjukkan wujud atau keadaan zat yang bersangkutan ( g = gass, l = liquid, s = solid dan aq = aqueous / larutan berair ).
- Bilangan yang mendahului rumus kimia zat disebut koefisien reaksi (untuk menyetarakan atom-atom sebelum dan sesudah reaksi).
- Koefisien reaksi juga menyatakan perbandingan paling sederhana dari partikel zat yang terlibat dalam reaksi.
Penulisan persamaan reaksi dapat dilakukan dengan 2 langkah :
1). Menuliskan rumus kimia zat pereaksi dan produk, lengkap dengan keterangan wujudnya.
2). Penyetaraan, yaitu memberi koefisien yang sesuai sehingga jumlah atom setiap unsur sama pada kedua ruas ( cara sederhana ).
Contoh :
Langkah 1 : (belum setara)
(belum setara)
Langkah 2 : (sudah setara)
(sudah setara)
b. Menyetarakan Persamaan Reaksi.
Langkah-langkahnya ( cara matematis ) :
a). Tetapkan koefisien salah satu zat, biasanya zat yang rumusnya paling kompleks = 1, sedangkan zat lain diberikan koefisien sementara dengan huruf.
b). Setarakan terlebih dahulu unsur yang terkait langsung dengan zat yang diberi koefisien 1 itu.
c). Setarakan unsur lainnya. Biasanya akan membantu jika atom O disetarakan paling akhir.
Contoh :
Langkah 1 : Persamaan reaksi yang belum setara.
Langkah 2 : Menetapkan koefisien C 2 H 6 = 1 sedangkan koefisien yang lain ditulis dengan huruf.
Langkah 3 : Jumlah atom di ruas kiri dan kanan :
| Atom | Ruas kiri | Ruas kanan |
| C | 2 | b |
| H | 6 | 2c |
| O | 2a | 2b+c |
Langkah 4 : Jumlah atom di ruas kiri = jumlah atom di ruas kanan.
Dari langkah 3, diperoleh :
b = 2 ……………. (i)
2c = 6 ……………. (ii)
2a = (2b + c) …….. (iii)
Dari persamaan (ii), diperoleh :
2c = 6
c = 6/2 = 3 ………. (iv)
Persamaan (i) dan (iv) disubstitusikan ke persamaan (iii) :
2a = (2b + c) …….. (iii)
2a = {(2).(2) + 3} = 7
a =7/2 …………… (v)
Langkah 5 : Nilai-nilai a, b dan c disubstitusikan ke persamaan reaksi :
Langkah 6 : Memeriksa kembali jumlah atom di ruas kiri dan kanan, serta melengkapi wujud zatnya.
2. Contoh-contoh Reaksi
Reaksi Penguraian
Reaksi penguraian adalah suatu reaksi senyawa tunggal terurai menjadi
dua atau lebih zat yang baru.
Contoh:
Jika amonium klorida dipanaskan maka akan terurai menjadi amonia dan asam klorida. Persamaan reaksinya:
NH4Cl(s) ⎯⎯→ NH3(g) + HCl(g)
Reaksi Penggabungan
Reaksi penggabungan adalah reaksi dimana dua buah zat atau lebih bergabung membentuk satu jenis zat yang baru.
Contoh:
Di atmosfir gas nitrogen dan gas hidrogen dapat bereaksi membentuk amonia dengan bantuan petir. Persamaan reaksinya: N2(g) + 3H2(g)⎯⎯→2NH3(g)
Reaksi Pendesakan
Reaksi pendesakan atau disebut juga reaksi pertukaran tunggal adalah reaksi dimana suatu unsur menggantikan posisi unsur lain dalam suatu senyawa.
Contoh:
Jika logam seng dicelupkan ke dalam larutan tembaga(II) sulfat akan menggantikan posisi tembaga. Persamaan reaksinya: Zn(s) + CuSO4(aq) ⎯⎯→ Cu(s) + ZnSO4(aq)
Reaksi Metatesis
Reaksi metatesis atau reaksi pertukaran ganda adalah reaksi kimia yang melibatkan pertukaran antar ion-ion dalam senyawa yang bereaksi.
Contoh:
Larutan natrium sulfat bereaksi dengan barium nitrat membentuk endapan putih dari barium sulfat. Persamaan reaksinya: Na2SO4(aq) + Ba(NO3)2(aq) ⎯⎯→ 2NaNO3(aq) + BaSO4(s)
Tinggalkan komentar